医療にかかわる方であれば、「ドラッグラグ」という言葉を一度は耳にしたことがあるのではないでしょうか。ドラッグラグとは、海外で使用されている薬が国内で承認され利用できるようになるまでの時間の差(ラグ)のことです。「海外では使用できる薬が日本ではまだ使えない」という事態が生じ、日本国内でも大きな問題として取り上げられています。
本記事では、ドラッグラグの現状や課題、改善に向けての取り組みを解説していきます。
製薬業界最新レポート
本資料では、臨床開発のペインポイント解消に向けたAI・デジタルの利活用や製薬企業がどのようにデジタル化やデータ活用を進めることができるのかを知ることができます。
無料でダウンロード可能です。ぜひご一読ください。

目次
ドラッグラグとは?
「ドラッグラグ」とは、海外で使用されている薬が日本国内で承認され利用できるようになるまでの時間の差(ラグ)のことです。医薬品の開発や承認は患者の安全を守るための重要なプロセスであるものの、以前から日本はドラッグラグが問題となっていました。
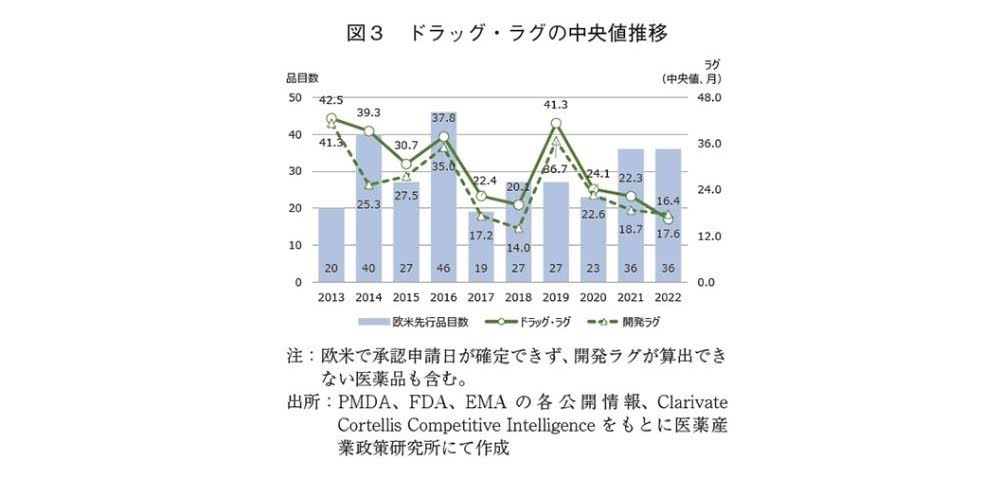
医薬産業政策研究所の調査によると、2013年から2016年における欧米と日本のドラッグラグの中央値は30ヶ月以上です。つまり、欧米で承認された薬が日本で使えるようになるまでに、2年以上の月日が経っているのがわかります。
近年の値を見ると、2017年以降はドラッグラグの中央値が20ヶ月台(2019年を除く)で、2022年は16.4ヶ月でした。改善の兆しが見えているものの、1年以上の差があるとして現在に渡り議論されてきました。
ドラッグラグとドラッグロスの違い
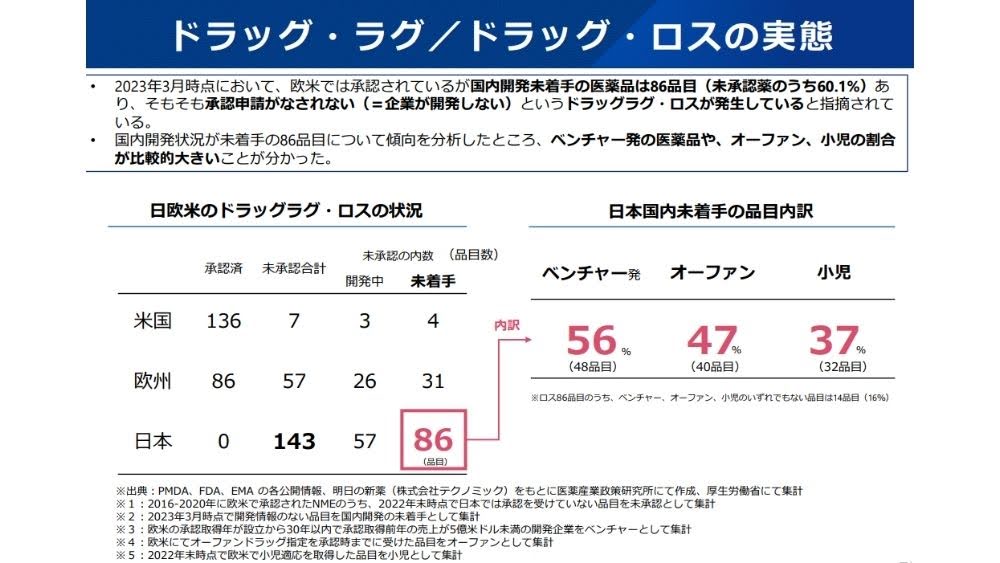
ドラッグラグと混同されがちな「ドラッグロス」とは、海外ではすでに使用されているが、日本では未開発(発売されていない)の薬が存在する状態のことです。一方でドラッグラグは、国内で薬が承認され利用できるようになるまでの遅れを意味します。
厚生労働省によると、2022年末時点で国内未承認の医薬品は143品目です。そのうちの60.1%(86品目)にのぼる医薬品にいたっては、国内の開発も未着手の状況です。中でもベンチャー初の医薬品やオーファン、小児の割合が大きくなっています。
ドラッグラグとドラッグロスに関しては以下の記事でも解説しています。ぜひお役立てください。
【専門家解説】新薬開発の今。臨床治験における被験者リクルート課題で生まれる「ドラッグラグ・ドラッグロス」
諸外国と比較した日本のドラッグラグの現状
世界で初めて薬が発売されてから各国での発売にいたるまでの国別平均期間を見比べましょう。(2010年の調査結果)
- アメリカ:0.9年
- イギリス:1.2年
- ドイツ:1.3年
- 日本:4.7年
2010年の調査であるため古い情報にはなりますが、日本のドラッグラグは欧米と比較しても長く、問題視されていました。2022年は16.4ヶ月であるため近年は徐々に改善傾向にあるものの、これまで他の国よりも時間がかかっていたのは事実です。
参考:Q39.「ドラッグ・ラグ」とはなんですか。国と製薬産業は、どのような取り組みをおこなっていますか。| 日本製薬工業協会
ドラッグラグが発生する主な原因
ドラッグラグは、おもに「開発ラグ」と「審査ラグ」によって引き起こされます。
- 開発ラグ:海外での治験が始まってから日本国内での治験が始まるまでの差
- 審査ラグ:新薬の審査にかかる期間の差
新薬の開発に着手する時点での遅れ(開発ラグ)と審査プロセスの長期化による遅れ(審査ラグ)が、国内での新薬利用の遅延を招いています。詳しく見ていきましょう。
開発着手の遅れ
日本市場における新薬の開発着手の遅れは、ドラッグラグの主要因です。海外での治験開始後、日本国内で開発に着手するまでにラグがあるため、全体的なドラッグラグが生じます。
PMDA(独立行政法人 医薬品医療機器総合機構)によると、令和3年度は0.3年、令和4年度は0.4年のラグがありました。国内未承認薬のうち60.1%(86品目)が開発未着手であることからも、国内での開発開始に時間を要していることがわかります。国内での臨床治験における参加者が不足していることも開発着手に遅れが出ている原因です。
ただ、近年は開発ラグが短くなってきています。
参考:ドラッグ・ラグの試算 | 独立行政法人 医薬品医療機器総合機構
審査長期化による遅れ
治験を終えて承認申請をした後、新薬の審査期間が長引くことによってもドラッグラグが生じます。ただ開発ラグに比べると審査ラグは少なく、令和3年度は0.1年、令和4年度は0年でした。
開発ラグと同じく、審査長期化による審査ラグも近年解消されています。
参考:ドラッグ・ラグの試算 | 独立行政法人 医薬品医療機器総合機構
ドラッグラグが引き起こす問題

ドラッグラグが引き起こす問題は、患者さんや医療従事者、社会全体に広がります。
- 患者さんが国内で効果的な治療を受けられない
- 医療格差が拡大する
- 医療の発展に遅れが生じる
それぞれの問題を詳しく見ていきましょう。
患者さんが国内で効果的な治療を受けられない
ドラッグラグが起こると、海外では認められて使用できる治療薬が、日本では未承認のため使用できないケースが生じます。つまり、海外では受けられる最先端の治療が日本だと受けられないことになり、患者さんの予後が悪化したり、生活の質が損なわれたりするケースが見られます。とくにがんや希少疾患においては、ドラッグラグは命に直結する深刻な問題です。
有効な治療を受けるためには海外へ行く必要性があり、莫大な医療費用がかかる点もドラッグラグが引き起こす問題のひとつです。
医療格差が拡大する
ドラッグラグが原因で海外で治療を受けることになった場合、莫大な医療費に加え渡航費、時間が必要になります。すると経済的余裕のある人は海外で治療を受けられる一方で、国内の限られた治療しか受けられない人も出てきます。
経済的理由により海外で治療を受けられる人と受けられない人が分別され、医療の格差が拡大するリスクが生じるでしょう。
医療の発展に遅れが生じる
新薬の開発・導入が遅れると、医療従事者が最新の治療法を習得する機会が失われ、医療技術全体の進歩が妨げられます。これにより新薬が進んでいる海外諸国に比べて医療技術や医療教育の面で後れを取ることも考えられますます。新薬が利用できないために、基礎研究から臨床応用、医療現場での技術革新まで、医療の発展に全体的な遅延を引き起こすのがドラッグラグによる問題です。
ドラッグラグ解消に向けた取り組み
さまざまな問題がある反面、日本ではドラッグラグ解消に向けてあらゆる対応を取ってきました。
- PMDA(医薬品医療機器総合機構)の強化
- 『先駆け審査指定制度』の導入
- 国際共同治験の推進
実際に上記のような取り組みのおかげで、承認期間が短縮されるといった成果も出ています。詳しく見ていきましょう。
また近年、医療現場におけるデジタルトランスフォーメーション(DX)が注目されています。現在の医療が抱える課題やDXの効果を以下記事で解説しているので、ぜひあわせてご覧ください。
デジタルトランスフォーメーション(DX)は医療が抱える課題を解決する?
PMDA(医薬品医療機器総合機構) の強化
PMDA(医薬品医療機器総合機構)とは、医薬品の承認プロセスを担う機関です。当局ではドラッグラグが発生する原因である審査ラグ改善に向けて審査員を増員し、新薬の審査スピードを上げる環境を整えました。
その結果、2006年から新有効成分の審査期間を大幅に短縮することに成功し、2012年から2022年までは世界最速レベルの審査期間を維持しています。
参考:令和6年度計画(案)【補足資料】│独立行政法人医薬品医療機器総合機構(資料p.10)
『先駆け審査指定制度』の導入
『先駆け審査指定制度』とは、一部の医薬品において、通常の半分の6ヶ月間で医薬品の承認を目指す制度です。治療薬として画期性のあるものや生命に重大な影響がある疾患の新薬を優先的に審査する仕組みで、平成27年度より試験的に開始されました。
令和元年の薬機法改正で「先駆的医薬品等指定制度」として法制化(令和2年9月施行)され、これにより新薬承認審査の短縮化が実現しています。
参考:令和5年度のこれまでの事業実績及び今後の取組みについて<審査・安全対策等業務>│独立行政法人医薬品医療機器総合機構(資料p.6)
国際共同治験の推進
国際共同治験とは、さまざまな地域・民族にまたがって臨床試験を実施することです。複数の国での同時開発、申請、承認を目指した世界規模の取り組みで、治験着手の遅れによるドラッグラグを防止できます。
これまで日本は国際共同治験に参加する件数が少なかったものの、近年は国際共同治験に積極的に参加する方針を採っています。
AIを活用した『Life Sciences Cloud』でドラッグラグ改善に貢献
『Life Sciences Cloud』は、Clinical、Medical、Commercialの3つの機能を持つ、エンドツーエンドのライフサイエンス企業向けの統合プラットフォームです。
Clinicalにおいては、臨床開発の効率化によってドラッグラグの解消に貢献することができます。具体的には被験者のリクルート、施設選定、プロトコル作成などをAIも活用しながら効率的に行うことができます。
今後は臨床開発の機能拡充も予定されており、臨床開発の高速化を実現するAIプラットフォームです。
ドラッグラグの知識を深め改善に向けて取り組もう

ドラッグラグとは、海外で使用されている薬が日本国内で承認され利用できるようになるまでの時間の差です。新薬の開発に着手する時点での開発ラグと審査プロセスの長期化による審査ラグが、国内での新薬利用の遅延を招いていました。
近年はPMDAの強化や『先駆け審査指定制度』の導入、国際共同治験の推進により、ドラッグラグ問題は改善に向かっています。ドラッグラグの知識を深め、オンライン治験の導入・電子カルテの活用などを通し、ドラッグラグの改善に向けて取り組みましょう。
製薬業界最新レポート
本資料では、臨床開発のペインポイント解消に向けたAI・デジタルの利活用や製薬企業がどのようにデジタル化やデータ活用を進めることができるのかを知ることができます。
無料でダウンロード可能です。ぜひご一読ください。